Анализ воды из колодцев на аммиак и ионы аммония
Содержание:
- Аммонийный азот
- Что такое аммоний
- Физические и химические свойства
- Способы очистки
- Нитраты в воде и последствия приема
- Способы очистки воды
- Влияние на сельскохозяйственные культуры
- Последствия отравления нитратами
- Замещённые соединения аммония
- Эффективные способы водоочистки от нитратов
- Способы очистки воды от нитратов
- Предельная норма концентрации нитратов в воде
- Как уберечь колодец от загрязнений
- Эффективные способы водоочистки от нитратов
- Что такое аммиак
- Причины поступления нитратов в воду
- Что такое нитриды
- Статья составлена с использованием следующих материалов:
Аммонийный азот
Аммонийный азот определяют методом отгонки из щелочного раствора или формалиновым методом.
Аммонийный азот определяют фотометрическим методом, основанным на образовании в щелочной среде желто-коричневого соединения иона аммония с иодомеркуриатом калия ( см. стр.
Аммонийный азот со своими тетраэдрически расположенными четырьмя заместителями подобен в стереохимическом отношении 5р3 — гибридизованному углероду.
Аммонийный азот в очищенных водах либо отсутствовал совсем, либо присутствовал в незначительных количествах ( 0 07 — 0 4 мг / л), нитраты содержались во всех пробах в концентрациях 5 8 — 19 3 мг / л, что свидетельствует о глубине процесса минерализации.
Аммонийный азот со своими четырьмя заместителями подобен в стереохимическом отношении углероду.
Аммонийный азот, огромная роль которого в жизни растений была впервые установлена работами Д. Н. Прянишникова, как оказалось в результате исследований, проведенных в последние годы, во многих случаях может быть более эффективно использован, чем нитратный, если только устранено побочное влияние физиологической или биологической кислотности аммонийных солей. Последнее, как известно, при необходимости ( на кислых почвах) может быть достигнуто применением извести или других нейтрализующих материалов.
Аммонийный азот находится в почве в форме поглощенного ( обменного) катиона и в виде водно-растворимых солей.
Аммонийный азот со своими тетраэдрически расположенными четырьмя заместителями подобен в стереохимическом отношении 5р3 — гибридизованному углероду.
Аммонийный азот удобрений при благоприятных условиях быстрее усваивается растениями.
Определению аммонийного азота с реактивом Несслера мешают соединения о несколькими 9ми днями группами, алифатические и ароматические амины, спирты, альдегиде, ацетон, органические хлор-амины и др. органические соединения, реагирующие о реактивом Несслера.
Количество аммонийного азота определяется путем отгона и улавливания NH3 из щелочной среды после подщелачивания кислой пробы.
Удаление аммонийного азота с помощью клиноптилолита предполагается осуществить на станции восстановления качества воды у оз.
Определению аммонийного азота с реактивом Несслера метают соединения с несколькими амиднями группами, алифатические и ароматические амины, спирты, альдегиде, ацетон, органические uep — аиинв я др. органические соединения, реагирующие с реактивом Несслера.
Определение аммонийного азота основано на образовании гексаметилентет-рамина при взаимодействии солей аммония с формалином. При этом выделяется минеральная кислота в количестве, эквивалентном находящимся в пробе аммонийным солям. Кислоту титруют раствором едкого натра, 1 мл которого соответствует 1 мг азота аммонийных солей. При подготовке пробы для осаждения углекислых солей добавляют хлористый барий.
Содержание аммонийного азота ( х) вычисляют по формуле, аналогичной приведенной на стр.
Что такое аммоний
Аммоний представляет собой катион, имеющий химическую формулу NH4+, Ион аммония представляет собой неорганический ион, состоящий из одного атома азота и четырех атомов водорода. У этого есть четыре N-H связи. Ион аммония является многоатомным. Молярная масса этого катиона составляет 18,039 г / моль. Название IUPAC аммоний-иона azanium.
Ион аммония имеет тригональную пирамидальную структуру. Здесь четыре N-H связи расположены в тригональной пирамидальной структуре. Поскольку в этой молекуле все связи одинаковы, угол связи составляет 109о, Молекула образуется, когда одиночная пара на атоме азота молекулы аммиака передается протону. Протон заставляет молекулу иметь положительный заряд. Степень окисления азота иона аммония составляет -3.
Рисунок 2: Химическая структура иона аммония
Ион аммония слабокислый. Может реагировать с основаниями и образовывать газообразный аммиак. Когда аммиак растворяется в воде, он может образовывать ионы аммония. Это равновесная реакция, которая сильно зависит от рН раствора. Реакция следующая.
ЧАС2O + NH3 ⇌ ОН− + NH+4
Ион аммония обычно можно найти в солях аммония. Соль аммония представляет собой химическое соединение, состоящее из катиона аммония и неорганического аниона. Некоторые примеры солей аммония включают хлорид аммония, сульфат аммония и карбонат аммония. Эти солевые соединения хорошо растворимы в воде.
Физические и химические свойства
Азот – химический элемент V группы системы Менделеева. Атомный номер – 7, атомная масса – 14,0067. Природный азот составлен из двух стабильных изотопов.
Азот – бесцветный газ, не имеющий запаха.
- Температура кипения – 195,80 °С,
- Температура плавления – 210,00 °С.
В воде малорастворим, легче воздуха. Молекулярный азот химически малоактивен. При комнатной температуре взаимодействует только с литием. При нагревании реагирует с кальцием, магнием, титаном. Реакция взаимодействия с водородом проходит под воздействием высоких температур, высокого давления и в присутствии катализатора, с кислородом – при температуре 3000–4000°С.
Наибольшее значение из соединений с водородом имеет аммиак – газ без цвета с характерным запахом нашатырного спирта.
С кислородом азот образует ряд оксидов: закись азота N2O, окись азота NO, диоксид азота NO2, азотистый ангидрид N2O3.
Способы очистки
При обнаружении в питьевой воде нитратных соединений нет необходимости полностью отказываться от эксплуатации колодца. Существуют способы, позволяющие избавиться от вредных примесей, изменить качественные характеристики воды и сделать ее пригодной для питья.
Обратный осмос
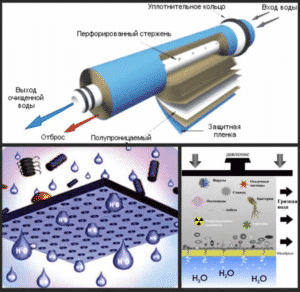
Принцип действия обратного осмоса.
Это инновационный метод очистки, позволяющий снизить уровень токсичных солей до нормального показателя. Специальные очистные элементы задерживают вредные соединения на мембранных перегородках.
Данный метод имеет следующие преимущества:
- надежность;
- легкость эксплуатации;
- доступность.
При установке отсутствует необходимость в крупных финансовых затратах и использовании энергетических ресурсов.
Этот метод имеет ряд недостатков:
- Высокая стоимость оборудования. Установка целесообразна при добывании питьевой воды из скважины.
- Перед поступлением на мембрану жидкость требует механической очистки.
- Удаляются не только вредные примеси, но и полезные соли и минералы. Из-за такой очистки вода теряет свою ценность.
Вода перегоняется через полупроницаемую мембрану, принцип фильтрации основан на односторонней диффузии и делении среды на две составляющие:
- Перекрестное течение: жидкость перемещается через мембрану по водопроводу, с другой стороны движется в противоположном направлении и очищает перегородку. Данная схема движения обеспечивается помпой.
- Ограничитель выполняет функцию контроля двустороннего перемещения. Устройство отслеживает количество жидкости после очистки и объем, поступивший в систему канализации.
Беспрерывно поддерживается давление, от которого зависит скорость прохождения через мембранные установки. Фильтрация повторяется циклами до полного очищения воды, которая выводится в специальный бак. Осадок скапливается в сточном резервуаре.
Установки небольших размеров используются в квартирах, стандартные системы монтируются в специальных помещениях.

Использование очистки воды способом обратного осмоса.
Ионный обмен для удаления нитратов
Фильтрующий механизм задерживает токсичные соединения благодаря 2 этапам очистки:
- Через водород-катионитный фильтр, где водород-катионы заменяют катионы.
- В анионитной установке, где анионы заменяются ионами.
Система требует регулярной регенерации смолы, для этого используются реагенты.
Другие особенности:
- Благодаря автоматизированной системе полностью исключается просачивание нитратных частиц.
- Циклы запускаются, не требуя вмешательства со стороны. Предусмотрен коэффициент запаса.
- При различном уровне солей азотной кислоты используются системы с разным количеством ступеней (от 1 до 3). На каждой ступени предусмотрены катионитный и анионитный фильтры. В механизмах с 1 или 2 ступенями используются разделенные среды, а в трехступенчатой системе возможна изолированная установка оборудования.
Данный метод очистки имеет ряд недостатков: низкий показатель гидрофильности смолы, высокие затраты на ее восстановление и необходимость утилизации при выработке ресурса
Необходимо устанавливать автоматизированную систему, в противном случае важно точно просчитывать время для регенерации, чтобы смола не потеряла фильтрующую способность. В случае ошибки возможен выброс токсичных солей

Принцип работы ионного обмена для удаления нитратов.
Цеолит
Для очистки воды от нитратов используются природные адсорбенты. Цеолит имеет пористое строение, в промежутках кристаллической структуры находятся положительные гидратированные ионы металлов, которые компенсируют заряд молекул воды.
Адсорбент обладает следующими особенностями:
- Поглощает и пропускает через свою структуру химические соединения, выполняя функцию сита.
- Обладает свойствами ионообменника катионного типа, очищает жидкость от тяжелых соединений металлов.
Для удаления токсичных солей материал используется в виде порошков и в составе фильтрующих систем. После отработки подвергается многократной регенерации. Очищающие слои могут состоять из цеолита, угля и шунгита. Умягчающие системы содержат над прослойкой цеолита слои ионообменной смолы и угля.
Нитраты в воде и последствия приема
Нитраты в питьевой водеОбычно нитраты могут попадаться только в грунтовых и поверхностных водах. Более редким, но все же возможным вариантом являются неглубокие скважины, чья глубина не превышает 30 метров. В артезианских скважинах этой кислоты практически не наблюдается. Попадают вредные вещества в воду с полей (в равнинных частях страны азотная кислота встречается в гораздо больших количествах в питьевой воде), со стоков. Образовываются нитраты после грозовых ливней в полях. Есть несколько степеней токсичности нитратов, где первая степень – это непосредственно нитраты, вторая – образованные из них нитриты и третья – образованные из вышеперечисленных соединений нитрозамины.
Длительное употребление данных веществ ведет к развитию метгемоглобинемии (характеризуется недостатком кислорода в дыхательных путях, из-за чего постепенно развивается отдышка, а позже дыхательные пути могут совсем закрыться). Нитраты пагубно воздействуют не только на дыхательную, но и на сердечно-сосудистую систему, ЖКТ и иные органы. Данное вещество особенно опасно для детей. У маленьких детей ферментная система еще не сформирована, а потом организм просто не подготовлен к борьбе с подобными загрязнителями.
Как временный вариант многие рассматривают приобретение бутилированной воды.
Способы очистки воды
Для тог чтобы очистить нитрированную воду можно использовать несколько действенных вариантов. Но, к сожалению, применение простого угольного фильтра не справится с поставленной задачей по очистке жидкости.
В современной геологической и геодезионной промышленности широко используют два способа очистки воды:
- Установка фильтра с анионными ионообменными мембранами;
- Установки, работающие по принципу обратного осмоса.
В первом случае ионные фильтры посредством ионной смолы задерживают ядовитые примеси нитратов на себе и подают в резервуар или кран уже очищенную воду из скважины или колодца. Однако подобный фильтр не способен справляться с большим объемом нитрированной воды и существует риск, что нитраты, осевшие на ионной смоле, попросту поступят назад в воду при перенасыщении ионного фильтра. При этом концентрация нитратных соединений может быть в разы выше. Использование ионного фильтра требует постоянного контроля качества воды. Поэтому сдавать её на анализ придётся чаще, чем раз в 2 месяца.
Более модернизированным и продуктивным является метод использования фильтра, работающего по принципу обратного осмоса. Конструкция такого фильтра состоит из трех катриждей, в которые вода из скважины или колодца подаётся под давлением и пропускается через специальную мембрану. При этом в первом катридже происходит предварительная очистка поступающей из скважины воды от крупных соединений и примесей, калибр которых равен 0,6 мм. После этого вода поступает в специальный накопитель, где проходит доочистку с помощью угольного фильтра. Последним этапом очистки воды является её прохождение через одномикронный фильтр. И только после этого система очищает воду через обратноосмотическую мембрану. Только после этого осуществляется подача воды в краны системы водоснабжения. В результате все вредные соединения выбрасываются в отдельный сточный коллектор и не грозят подорвать здоровье человека.
Срок службы обратноосмотической мембраны напрямую зависит от количества перекачиваемой через неё воды.
Важно: во всем мире жидкость, очищенная посредством системы осмоса, считается идеально чистой и пригодной к употреблению даже в сыром виде. Мембрана осмоса помимо нитратов удаляет из воды все вредные соединения, такие как железо, марганец, песок и пр
Поэтому анализ показывает абсолютно чистую и готовую к употреблению воду.
Влияние на сельскохозяйственные культуры
Азотным удобрениям принадлежит ведущая роль в повышении урожайности различных сельскохозяйственных культур
Это связано с ролью азота как важного биологического элемента, играющего исключительную роль в жизни растений
Достаточное снабжение азотом усиливает синтез органических азотистых веществ. У растений образуются мощные листья и стебли, интенсивность зеленой окраски усиливается. Растения хорошо растут и кустятся, улучшается формирование и развитие органов плодоношения. Эти процессы способствуют повышению урожайности и содержанию белка.
Однако необходимо учитывать, что односторонний избыток азота может задерживать созревание растений, способствуя развитию вегетативной массы при уменьшении развития зерна, корнеплодов или клубней. У льна, зерновых и некоторых других культур избыток азота вызывает полегание (фото) и ухудшение качества растениеводческой продукции.
Так, в клубнях картофеля может снизиться содержание крахмала. В корнеплодах сахарной свеклы снижается сахаристость и возрастает содержание небелкового азота.
Последствия отравления нитратами
Нитратная вода вредна как для человека, так и для животных, которые ее употребляют. Основная опасность в том, что сразу не видно отравляющего эффекта. Он выявляется спустя время. Иногда с последствиями бывает сложно справиться. Врачи утверждают, что при длительном употреблении в пищу воды, зараженной нитратными соединениями, развиваются онкологические заболевания. Поражаются чаще других органы ЖКТ. У пациентов с ослабленным здоровьем развивается рак желудка, поджелудочной железы. Нитраты легко вступают в реакцию с йодом. В результате такого взаимодействия страдает щитовидная железа. Она постоянно работает в запредельном режиме, увеличивается в размерах. В дальнейшем наблюдается узловой или диффузный зоб, другие заболевания эндокринной системы.
Замещённые соединения аммония
Органические
Атомы водорода в аммонии могут быть замещены на органические радикалы. Существуют соединения одно-, двух-, трёх- и даже четырёхзамещённого аммония. Гидроксиды четырёхзамещённого аммония (например, гидроксид тетраметиламмония) могут быть выделены в свободном состоянии и являются намного более сильными щелочами, чем сам аммоний и его производные меньшей степени замещения.
Неорганические
Тетрафтораммоний [NF4]+ представляет собой аммоний, все четыре атома водорода в котором замещены фтором. Тетрафтораммоний является одним из немногих соединений, в которых азот имеет степень окисления +5, является сильнейшим окислителем и устойчив только в соединении с комплексными фтористыми анионами, например, тетрафторборатом [BF4]−.
Эффективные способы водоочистки от нитратов
Наличие нитратных загрязнений – не повод отказаться от использования источника. Если обнаружены нитраты в скважине, что делать подскажут сотрудники лаборатории, когда будут выдавать заключение.
Определение нитратов в воде в домашних условиях:
Еще один способ – воспользоваться рекомендациями, опубликованными далее. Все существует 2 способа решить проблему, которые достаточно эффективны, чтобы дать жильцам дома чистую питьевую воду.
Очистка обратным осмосом
Суть методики – перекачка жидкости через установку со специальной мембраной, удерживающей загрязнения. При этом молекулы воды беспрепятственно проходят сквозь нее, а удерживаются только нежелательные примеси. Способ нашел применение в промышленности и может применяться в домашних условиях.
Сама мембрана также требует периодической очистки, которую выполняют с применением перекрестного течения. С одной стороны напор направляет жидкость на мембрану для фильтрации. С другой – струя омывает саму мембрану, удаляя примеси. Чтобы направить жидкость в обратном направлении, потребуется специальная помпа.
Метод отличается эффективностью, но и не лишен недостатков:
- Требуется предварительная очистка механическим способом, чтобы удалить из скважинной или колодезной воды песок, глину, ил и другие твердые нерастворимые частицы.
- Очистка предполагает удаление всех имеющихся солей, включая те, которые приносят организму человека пользу. Если скважина артезианская, вода утратит свои целебные свойства.
- Стоимость нельзя назвать низкой. Для выхода из ситуации используют небольшие фильтрационные установки, производительности которых достаточно, чтобы перерабатывать воду для питья и приготовления пищи.
В любом случае жидкость, фильтруемая таким образом, будет лишена вредных примесей, которые содержатся в водном растворе.
Очистка ионным обменом
Чтобы извлечь из раствора отрицательно заряженные частицы нитран-ионов используются селективные смолы. Очистка предполагает протекание химической реакции с применением специальных составов и веществ. Метод сложен тем, что необходимо заботиться о своевременной регенерации смолы, ионы которой замещаются ионами нитратов. Поэтому данный способ применяется крайне редко, тем более, что для этого требуется специальная установка, требующая обслуживания.
Способы очистки воды от нитратов
В случае, если в Вашей исходной воде наблюдается повышенное содержание нитратов, необходима ее очистка.
На сегодняшний момент наиболее широкое распространение получили два метода удаления нитратов из воды:
- с помощью установок обратного осмоса
- специальными фильтрами с селективными анионными ионообменными материалами.
Иногда для удаления нитрат-ионов могут использоваться ионообменные смолы — универсальные сильноосновные аниониты, но, в подавляющем большинстве случаев, требуется применение специальных нитратселективных анионитов. Физическая суть данного метода сводится к замещению нитрат-ионом аниона смолы, как правило, хлорид-иона с последующей регенерацией материала раствором хлорида натрия (поваренной соли). Это обуславливает особенности и ограничения при использовании данного метода.Ионообменная смола характеризуется ограниченной емкостью — тем количеством анионов, которое она может на себя принять, обеспечивая необходимую степень очистки воды. При полном насыщении смолы дальнейшее удаление извлекаемых ионов прекращается. При использовании стандартной сильноосновной смолы и присутствии в исходной воде сульфатов может даже наблюдаться выброс нитратов в очищенную воду при исчерпании ресурса фильтра. Это обусловлено большим сродством стандартной сильноосновной смолы к сульфатам, чем к нитратам, что ведет к вытеснению задержанных нитрат-ионов сульфат-ионами из смолы.В случае выброса нитратов из фильтра, их концентрация в воде может достигать очень высоких значений, представляющих серьезную опасность для здоровья, при этом определить подобное превышение без анализа воды потребитель не может. По этой причине удаление нитратов с помощью ионных фильтров не рекомендуется для частных домов, где отсутствует возможность организации постоянного контроля за качеством очищенной воды.
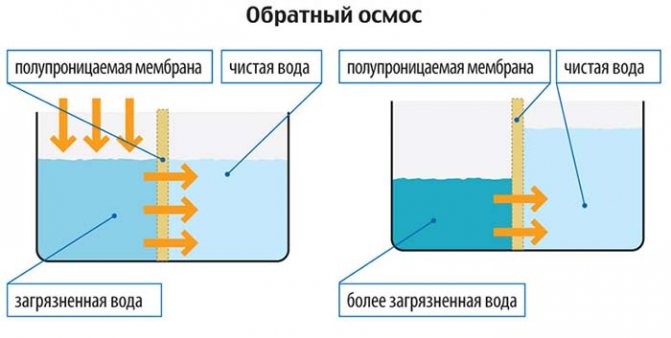
Очистка воды от нитратов с помощью обратного осмоса является более надежным вариантом. Вода под давлением подается на полупроницаемую мембрану. Нитраты и другие примеси задерживаются мембраной, а к потребителю поступает очищенная вода. Степень извлечения примесей определяется селективностью мембраны. В зависимости от модели мембраны и конструкции установки обратного осмоса удаление нитратов может достигать до 96%.В случае использования установок обратного осмоса качество очистки остается стабильным даже при значительном изменении состава исходной воды. Помимо удаления нитратов, установки обратного осмоса будут справляться с задачами по очистке воды от большого спектра загрязнений (железо, марганец, цветность и т. д).Частое выявление присутствия нитратов в высоких концентрациях в источниках водоснабжения частных домов позволяет констатировать, что очистка воды от нитрат-ионов все чаще является насущной необходимостью. Для очистки воды от нитратов оптимальным решением является обратный осмос.
По всем вопросам очистки воды обращайтесь к нам — опытные специалисты по водоподготовке проконсультируют Вас по любой проблеме, связанной с водой для Вашего дома.Для консультации с нашими специалистами позвоните нам или отправьте заявку
Рекомендуем прочитать:
Предельная норма концентрации нитратов в воде
В допустимых нормах нитраты не окажутся вредными, даже если будут ежедневно попадать в организм. Токсикологическое воздействие на организм не оказывается, если количество солей в жидкости не превышает 45 мг/л. Европейские страны устанавливают нормы собственные. В некоторых регионах допускается использование воды с содержание нитратных соединений до 50 мг/л. Зато для производства напитков вода очищается. Показатель количества солей должен быть опущен до 10 мг/л. На данную цифру необходимо ориентироваться при выборе воды для приготовления пищи. Особенно много нитратов может быть в плодах, которые содержат в себе много воды, например, в арбузах и дынях. Сделать экспресс-тест на содержание нитратов перед покупкой можно с помощью прибора Эковизор. Так же с его помощью можно определить жесткость воды.
Как уберечь колодец от загрязнений
О безопасности колодезной воды следует подумать еще на этапе планирования места расположения этого источника. Еще наши предки знали, что не на всяком месте можно копать колодец, и обязательно придерживались этих законов. И это были вовсе не суеверия, а разумное планирование.
Как защитить колодец от загрязнения?
1. Не копайте колодец рядом с оживленной автотрассой, недалеко от огородов и полей. Расстояние от колодца до этих и им подобных потенциальных источников загрязнения подземных вод должно превышать 500 м. К последним, кроме вышеперечисленных, относятся:
- места хранения удобрений и химических препаратов для защиты растений, а также поля, где эта продукция используется;
- мусорные свалки;
- места хранения навоза и компоста – эти полезные для растений удобрения могут нанести большой вред вашему здоровью, если попадут в питьевую воду;
- сараи, где содержатся домашние животные;
- уличные туалеты с неизолированными выгребными ямами.
2. Если нет возможности выкопать колодец на большом расстоянии от огорода, используйте удобрения строго в разрешенных дозировках, а от применения пестицидов постарайтесь вообще отказаться. Подобными действиями вы убьете сразу двух зайцев – и воду защитите от загрязнения, и продукцию вырастите экологически чистую.
3. Туалеты и места хранения навоза расположите в таком месте, чтобы их содержимое не смогло попасть в подземные воды, из которых вода прибывает в колодец.
4. Предусмотрите возможность отвода от колодца дождевой воды и талого снега.
5. Не используйте соль для посыпания дорожек во время гололеда, если они расположены близко к колодцу. Весной, когда начнет таять снег, эта соль растворится и попадет в грунтовые воды, а оттуда – в ваш колодец и в вашу пищу.
6. Территорию возле колодца всегда содержите в чистоте.
7. После строительства колодца все стыки между бетонными кольцами надежно заделайте в целях герметизации.
8. Устройте также вокруг колодца защитный слой из основательно промятой и тщательно уплотненной глины. Глубина такой защиты должна составлять 1,8-2 м от поверхности земли, а ширина – 1-2 м. Благодаря своим свойствам, глина является природным фильтром, проходя через который вода очищается. К сожалению, подобный защитный слой в состоянии спасти колодец лишь от тех загрязнений, которые находятся вблизи него.
9. Соорудите над колодцем оголовок с закрывающейся крышкой, который будет защищать источник питьевой воды от дождя, мусора, песка, пыли, листьев и т.д.
10. Регулярно очищайте колодец от мусора и попавших туда предметов.
Эффективные способы водоочистки от нитратов
Чтобы выбрать эффективный способ водоочистки, необходимо знать норматив, который установлен ВОЗ по ПДК (предельно-допустимой концентрации) нитратов.
Норма нитратов в воде составляет 45 мг на литр, в некоторых европейских государствах норма может быть увеличена до 50 мг на литр. Вода для приготовления пищи и напитков не должна содержать больше 10 мг/л нитратов.
Быстро и качественно удалить нитраты из воды можно профессиональными очистными установками обратного осмоса и ионного обмена.
Очистка обратным осмосом
Подобный метод позволяет убрать большую часть нитратов в воде, добытой из скважины при помощи особых очистных элементов, которые эффективно фильтруют поступающую жидкость. Глубокая фильтрация позволяет задерживать вредные вещества и примеси на мембранах-перегородках.
Процесс очистки повторяется циклично до получения чистой воды, которая выводится в специальный бак, а осадок — в сточный резервуар.
Принцип осмоса основан на разделении жидкого вещества на два раствора, имеющих различную концентрацию. В рабочей системе поддерживается постоянное давление осмоса, которое определяет скорость прохождения жидкости через фильтрующие мембраны.
Система обратного осмоса — инновационный способ фильтрации воды, который позволяет снизить повышенное содержание имеющихся нитратов в воде до нормальных показателей.
Главное преимущество обратного осмоса — надежность конструкции, доступная установка и простота эксплуатации. Установить и настроить подобную систему достаточно просто, кроме того, она не требует больших энергетических и финансовых затрат на свое обслуживание.
Обратный осмос эффективен для снижения уровня нитратов, который превышает 35 г/л, а также для уменьшения сухой остаточной массы в воде.
Главный недостаток подобного способа очистки — высокая цена на готовый комплект. Малогабаритные установки предназначены для монтажа под кухонной мойкой, стандартные установки — для размещения в специальных помещениях. Системы обратного осмоса не менее востребованы в городских квартирах для фильтрации водопроводной воды.
Очистка ионным обменом
Принцип ионного обмена предусматривает многоступенчатую фильтрацию поступающей жидкости, в результате чего опасные ионы вытесняются полезными соединениями.
Ионообменный фильтр позволяет быстро и качественно очистить воду от нитратных и прочих примесей, а также уменьшить ее жесткость.
Подобная фильтрация успешно используется в промышленности, сельском хозяйстве и быту.
В частном домовладении часто используется одноступенчатая схема ионообменной очистки воды, которая имеет ряд недостатков. В ней задействуется небольшое количество реагентов, которые при этом требуют больших водных ресурсов для промывки ионита от образовавшегося осадка. Кроме того, подобная установка не гарантирует высокое качество фильтрации в отличие от многоступенчатых схем, эффективное воздействие которых зависит от применения кислотных водородных катионов.
Чтобы выбрать наиболее подходящий вариант очистки воды от нитритов, проводятся следующие мероприятия:
- санитарная экспертиза водозаборной точки для выявления возможных источников загрязнения воды, а также способов их нейтрализации;
- лабораторный анализ на определение нитратов в воде, а также полного химического и бактериологического состава.
На основании полученных данных принимается решение о выборе лучшего способа решения подобной проблемы.
От нитратных соединений в воде можно избавиться и другими доступными способами, но указанные в статье, являются самыми результативными. Чтобы обеспечить дом чистой водой и оградить себя от негативного влияния нитратов, стоит заранее позаботиться об установке эффективной и безопасной водоочистной системы.
Это интересно: Отделка гипсокартона под обои своими руками — рассматриваем досконально
Что такое аммиак
Аммиак представляет собой неорганическое соединение, имеющее химическую формулу NH3, Это газообразное соединение. Молярная масса аммиака составляет 17,031 г / моль. Это соединение является щелочным и имеет характерный едкий запах. ИЮПАК название аммиака azane.
Геометрия аммиака является тригональной пирамидальной. Здесь тригональная пирамида состоит из трех N-H связей и неподеленной электронной пары на атоме азота. Хотя угол связи молекулы с типичной тригональной пирамидальной структурой составляет 109оиз-за наличия неподеленной пары угол связи в молекуле аммиака был уменьшен до 107о.
Рисунок 1: Химическая структура аммиака
Температура плавления аммиака составляет -77,73.оС и точка кипения составляет около -33,34оC
Принимая во внимание плотность аммиака, он легче воздуха. Поскольку в этом соединении присутствуют N-H связи, аммиак легко превращается в жидкий аммиак
Это связано с тем, что связи N-H могут образовывать прочные водородные связи друг с другом. Когда жидкий аммиак замерзает до точки плавления, он начинает образовывать белые кристаллы.
Аммиак смешивается с водой благодаря способности образовывать водородные связи с молекулами воды. Кипящий водный раствор аммиака может вытеснить аммиак из воды, поскольку аммиак имеет очень низкую температуру кипения по сравнению с температурой кипения воды. Аммиак может подвергаться сгоранию в присутствии кислорода. Сжигание аммиака можно наблюдать как пламя бледно-желтого цвета.
Причины поступления нитратов в воду
Главная причина появления этих соединения в водоносных пластах – применение селитры в качестве удобрений в сельском хозяйстве. В этом случае человек сталкивается с солями азотной кислоты, которые растворяются в воде, и грунт естественным образом не может препятствовать их протеканию в колодец или скважину.
Есть и другие причины, по которым процентное содержание нитратов в жидкости превышает установленные нормы:
- Близость скоплений бытовых отходов и фекалий. В данном случае соединения образуются в результате распада органических отходов. Септик, баня, туалет, выгребная яма – потенциальные источники опасности.
- Слив отработанной моющей жидкости. Применение чистящих и моющих средств предполагает утилизацию грязной воды. Если она сливается в непосредственной близости от колодца или скважины, содержание нитратов резко возрастает.
- Массовые захоронения, и не только кладбища, являются источником проблемы, так как при разложении тканей животных образуются вредные вещества, способные нанести непоправимый урон организму человека.
В любом случае, выявить проблему поможет специализированная экспертиза и анализ контрольных проб. Заключения выдают специализированные санитарно-эпидемологические лаборатории. И как только проблема будет выявлена, нужно немедленно приступить к ее ликвидации.
Это интересно: Строительство бетонных гаражей
Что такое нитриды
Азот способен соединяться с более электроположительными атомами металлической и неметаллической природы. В результате образуются соединения схожие с гидридами и карбидами. Такие вещества азотсодержащие называют нитриды. Между металлом и азотным атомом в соединениях выделяют ковалентную, ионную и промежуточную связи. Именно такая характеристика лежит в основе их классификации.
К нитридам ковалентным относят соединения, в химической связи которых электроны не переходят от атомарного азота, а образуют вместе с заряженными отрицательно частицами других атомов общее электронное облако.
Примером таких веществ являются водородные нитриды, типа аммиачных и гидразиновых молекул, а также азотные галогениды, к которым относят трихлориды, трибромиды и трифториды. У них общая электронная пара одинаково принадлежит двум атомам.
К нитридам ионным относят соединения с химической связью, образованной переходом электронов от элемента металла на свободные уровни у азота. В молекулах таких веществ наблюдается полярность. Нитриды имеют степень окисления азота 3-. Соответственно, общий заряд металла будет 3+.
К таким соединениям относят нитриды магния, лития, цинка или меди, за исключением щелочных металлов. Они обладают высокой температурой плавления.
К нитридам с промежуточной связью относятся вещества, у которых распределены равномерно атомы металлов и азота и отсутствует четкое смещение электронного облака. К таким инертным соединениям принадлежат нитриды железа, молибдена, марганца и вольфрама .
Статья составлена с использованием следующих материалов:
Вильдфлуш И. Р., Цыганов А. Р., Лапа В. В., Персикова Т. Ф. Рациональное применение удобрений: Пособие. – Горки: Белорусская государственная сельскохозяйственная академия, 2002.– 324 с.
2.
Вильдфлуш И.Р., Кукреш С.П., Ионас В.А. Агрохимия: Учебник – 2-е изд., доп. И перераб. – Мн.: Ураджай, 2001 – 488 с., ил.
3.
Глинка Н.Л. Общая химия. Учебник для ВУЗов. Изд: Л: Химия, 1985 г, с 731
4.
Минеев В.Г. Агрохимия: Учебник.– 2-е издание, переработанное и дополненное.– М.: Издательство МГУ, Издательство «КолосС», 2004.– 720 с., л. ил.: ил. – (Классический университетский учебник).
5.
Петров Б.А., Селиверстов Н.Ф. Минеральное питание растений. Справочное пособие для студентов и огородников. Екатеринбург, 1998. 79 с.
6.
Химическая энциклопедия: в пяти томах: т.1: А-Дарзана/Редкол.: Кнунянц И.Л. (гл. ред.) и др. – М.: Советская энциклопедия, 1988. – 623.: ил
7.
Энциклопедия для детей. Том 17. Химия. / Глав. ред. В.А. Володин. – М.: Аванта +, 2000. – 640 с., ил.
8.
Ягодин Б.А., Жуков Ю.П., Кобзаренко В.И. Агрохимия / Под редакцией Б.А. Ягодина.– М.: Колос, 2002.– 584 с.: ил (Учебники и учебные пособия для студентов высших учебных заведений).
Изображения (переработаны):
9.
A farmer’s primer on growing soybeans_p61, by IRRI Images, по лицензии CC BY
10.
Liquid Nitrogen, PicoCon, Imperial College, London, UK.JPG, by Cory Doctorow, по лицензии CC BY-SA
11.
Nitrogen deficiency in wheat, by CIMMYT, по лицензии CC BY-NC-SA
12.
Nutrient excess or toxicity (general), by David B. Langston, University of Georgia, Bugwood.org, по лицензии CC BY
13.
Soybean Glycine max, by J.G. Davis, Bugwood.org, по лицензии CC BY
Свернуть
Список всех источников